HỘI CHỨNG PIERRE ROBIN NHÂN MỘT TRƯỜNG HỢP
Nguyễn Thái Bình, Bùi Văn Lệnh.
Khoa Chẩn đoán hình ảnh – Bệnh viện Đại Học Y Hà Nội
SUMMARY
Syndrome Pierre Robin (SPR) is the rare sequence of malformations. It presents with a classic triad of micrognathia, glossoptosis, and cleft palate. In this report, we presented the maxilo-facial CT finding in a case with typical SPR. The authors provide a short review of the literature and describe all the anormalies in CT images of the patient for diagnosis and introduce the performances to control the syndrome.
Keywords: Cleft palate, feeding plate, micrognathia, palatal feeding obturator, Pierre Robin sequence
I. ĐẶT VẤN ĐỀ
Hội chứng Pierre Robin (SPR) là một chuỗi các dị tật bẩm sinh hiếm gặp, theo các tác giả Mỹ, tỷ lệ gặp khoảng 1:8500 trẻ, tỷ lệ nam: nữ khoảng 1:1 [2]. Hội chứng này được Pierre Robin báo cáo lần đầu tiên năm 1926 . Bệnh được tác giả định nghĩa là dị tật bẩm sinh, bao gồm bộ ba triệu chứng là cằm nhỏ, lưỡi bị đẩy về phía sau và hở vòm miệng (thường là hở màng mềm phía sau) [1]. Bệnh thường được chẩn đoán ở giai đoạn cuối của thai kì bằng siêu âm thai. Khi trẻ ra đời có bộ mặt biến dạng với cằm nhỏ, nhọn nên còn gọi là người có bộ mặt “chim”. Ngày nay hội chứng được xác định là do đột biến gen trên các nhiễm sắc thể số 2, 11 hoặc 17 [3]. SPR thường xuất hiện lẻ tẻ ngẫu nhiên trong cộng đồng nhưng cũng có khoảng 10-15% các ca có tính gia đình.
Trong quá trình phát triển, vào khoảng tuần thứ 7 tới tuần thứ 11 bào thai, xương hàm dưới ngừng phát triển, cằm chỉ ngang mức khớp ức đòn (theo chiều trước sau) và nằm cao hơn so với bình thường, dẫn tới lưỡi bị giữ ở vị trí cao và ra sau hơn, vòm miệng không đóng được và hở dạng hình chữ U, đường thở trên bị hẹp do lưỡi chèn ép, mềm sụn thanh quản, dẫn tới tiếng thở khó và thở rít giống tiếng mèo kêu [1]. Trí não và thể chất của trẻ sẽ phát triển bình thường nếu được chăm sóc tốt.
Các triệu chứng trên gây cho trẻ khó thở, khó ăn, mục tiêu của điều trị là tránh tắc nghẽn đường thở và cung cấp đủ chất dinh dưỡng.
Chúng tôi báo cáo một trường hợp hội chứng Pierre Robin được phát hiện khá muộn nhằm đưa ra kinh nghiệm chẩn đoán và giới thiệu hướng chăm sóc, điều trị.
II. GIỚI THIỆU BỆNH ÁN
Bệnh nhân nữ 4 tuổi là con thứ hai, vào viện khám vì bất thường cằm nhỏ.
Tiền sử gia gia đình, có bố đẻ công tác ở vùng nhiễm chất độc da cam, hiện tại sức khỏe bình thường. Mẹ đẻ không có bệnh lý gì đặc biệt, có con đầu 6 tuổi dị tật bại não bẩm sinh. Thai nghén lần 2 đi siêu âm nhiều lần, tới tháng thứ 8 phát hiện thai có dị tật cằm nhỏ, không quyết định bỏ thai. Sau sinh có xét nghiệm nhiễm sắc thể không phát hiện gì đặc biệt.
Lâm sàng có dị tật cằm nhỏ: xương hàm dưới nhỏ, cằm tụt vào trong và lên trên so với vị trí bình thường, hở hàm ếch, ăn uống không ho, sặc, không khó thở. Trí tuệ và thể chất phát triển bình thường. Khám hệ cơ xương khớp bình thường.
Xét nghiệm công thức máu và sinh hóa bình thường. Xét nghiệm di truyền không thấy bất thường nhiễm sắc thể, chưa làm xét nghiệm gen.
Chẩn đoán hình ảnh: Siêu âm ổ bụng: không thấy bất thường các cơ quan trong ổ bụng. Chụp Cắt lớp vi tính sọ não: hình thái hai bán cầu và các cấu trúc bình thường, không teo não, không ứ nước não thất. Cắt lớp vi tính hàm mặt: xương hàm dưới teo nhỏ, lưỡi tụt về phía sau, cung răng dưới tụt vào trong so với cung răng trên gây khớp cắn lệch. Xương khẩu cái liên tục. Trên hình ảnh tái tạo theo mặt phẳng đứng dọc có hẹp nhẹ đường dẫn khí. Tái tạo xương đá hai bên: xoang chũm và tai giữa chứa dịch, chuỗi xương con không thấy bị tổn thương. Các xương khác vùng hàm mặt không thấy bất thường. Răng: các mầm răng vĩnh viễn, các răng sữa mọc không cân xứng hai bên.
Nội soi tai mũi họng thấy có hình ảnh hở vòm dạng chữ U.
III. BÀN LUẬN
3.1. Lịch sử
Lannelonguen và Menard là người đầu tiên mô tả bệnh trên hai bệnh nhân năm 1891 với các biểu hiện cằm nhỏ, hở vòm. Vào năm 1926, nhà phẫu thuật người Pháp, Pierre Robin đã mô tả được một cách đầy đủ bộ ba triệu trứng của hội chứng này trên một bài báo chính thức [1]. Thuật ngữ “sequence” được sử dụng vì hầu hết triệu chứng còn lại đều là thứ phát do một dị tật là xương hàm dưới teo nhỏ. Ngày nay, các tác giả trên thế giới đã chứng minh được hội chứng Pierre Robin có thể mắc đơn thuần hoặc phối hợp nhiều hội chứng dị tật bẩm sinh khác [3]. Trường hợp của chúng tôi có bố sống một thời gian ở vùng có chất độc da cam. Liệu có liên quan đến biến đổi gen? Cần xét nghiệm thêm về gen mới xác định được (xét nghiệm nhiễm sắc thể chưa phát hiện được bất thường).
3.2. Chẩn đoán hội chứng Pierre Robin
Bệnh nhân có hội chứng Pierre Robin cần được thăm khám và đánh giá một cách đầy đủ các dị tật để có hướng điều trị tốt nhất.
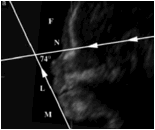
Về thời gian chẩn đoán, hội chứng Pierre Robin có thể chẩn đoán được ở giai đoạn ba tháng cuối của thời kỳ bào thai trên siêu âm với dấu hiệu hàm dưới nhỏ, cằm không phát triển quá mặt phẳng qua khớp ức đòn. Thăm khám sau sinh có thể phát hiện dễ dàng bộ ba dị tật. Theo M. Entezami [5], bệnh có thể chẩn đoán sớm nhất ở giai đoạn 2 của thai kỳ. Rotten nghiên cứu 12 thai nhi tuần từ 18 tới 28 [9] bằng cách đo góc mặt – trán đo trên hướng cắt đứng dọc. Tác giả nhận thấy góc mặt – trán có giá trị khoảng 65,5o ± 8,13 o ở thai bình thường và < 50o ở thai có tật cằm nhỏ với độ nhạy và độ đặc hiệu gần bằng 1. ( hình 1).
- a
- b
Hình 1: A: góc mặt–trán ở thai bình thường. B: Góc mặt-trán ở thai có dị tật cằm nhỏ
Góc mặt – trán là góc giữa đường thẳng vuông góc với mặt phẳng trán đi qua gốc xương mũi và đường thẳng tiếp xúc với môi, cằm.
Ngoài ra tác giả so sánh độ rộng giữa hàm dưới / hàm trên (MD/MX). Chẩn đoán dương tính nếu MD/MX <0.785.
- a
- b
Hình 2:
A: Hình cắt ngang qua cung răng trên (thấy huyệt răng nanh), kẻ đoạn thẳng qua điểm giữa cung răng trên về phía sau, MX là khoảng cách giữa bản ngoài xương hàm trên tới điểm giữa của đoạn thẳng trên
B: Hình cắt ngang qua cung răng dưới, MD được đo tương tự như trên.
Hai cách đo này được coi là tiêu chuẩn chẩn đoán xác định trên siêu âm thai
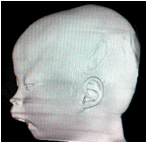
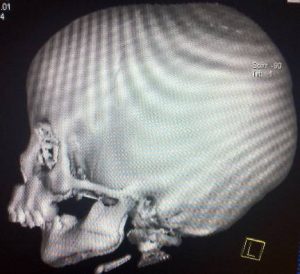
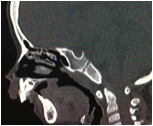
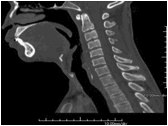
Sau sinh, bệnh được chẩn đoán khá dễ dàng bằng thăm khám lâm sàng phát hiện bộ ba dị tật. Chúng tôi tiến hành chụp cắt lớp vi tính với độ dày lát cắt 1mm từ cằm tới da vùng đỉnh đầu ở bệnh nhân này, tái tạo ảnh theo các mặt phẳng và theo không gian ba chiều nhằm chẩn đoán đầy đủ các bất thường vùng hàm mặt (hình 3).
Hình 3: Bệnh nhân có dị tật cằm nhỏ do xương hàm dưới thiểu sản
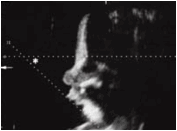
Về đánh giá hẹp đường thở và chức năng hô hấp rất quan trọng. Hẹp đường thở nguyên nhân do lưỡi bị đẩy về phía sau và lên trên, biểu hiện bằng khó thở, tím tái. Cần đặc biệt chú ý khi bệnh nhân ngủ trong tư thế nằm ngửa, cơ lưỡi giảm trương lực và chèn về phía sau sát với vòm họng, do vậy tiếng thở của bệnh nhân khi nhủ giống tiếng mèo kêu, thậm chí có thể ngạt thở khi ngủ [4]. Chụp cắt lớp vi tính dựng hình theo mặt phẳng đứng dọc với tư thế bệnh nhân nằm ngửa có thể cho phép đo được khoảng cách giữa gốc lưỡi và thành sau vòm họng. Bệnh nhân trên không có biểu hiện khó thở, nhưng trên phim chụp CLVT thấy có dấu hiệu hẹp nhẹ đường thở trên (hình 4).
- a
- b
Hình 4: A: Hình tái tạo theo mặt phẳng đứng dọc của bệnh nhân trên (cho phép đánh giá mức độ hẹp đường thở trên ở tư thế nằm ngửa): có hẹp nhẹ đường thở sau gốc lưỡi kèm theo thiếu sót khẩu cái mềm.B: Hình ảnh các cấu trúc của khoang hầu họng bình thường
Về dị tật hở hàm ếch: nguyên nhân do lưỡi bị đẩy về phía sau và lên trên, dẫn tới khẩu cái mềm không đóng được ở thời kỳ bào thai. Chính vì vậy dị tật hở hàm ếch kiểu chữ U thường gặp hơn kiểu chữ V. Hở hàm ếch dẫn tới tình trạng khó khăn trong việc bú sữa của trẻ, bệnh nhân thường bú yếu và dễ bị ho sặc. Tình trạng khó thở cũng tăng lên khi bệnh nhân bú sữa và trẻ phải gắng sức hơn. Ở trẻ lớn, do phối hợp khớp cắn lệch nên bệnh nhân gặp khó khăn trong việc nhai, nghiền và nuốt thức ăn. Từ đó trẻ có thể bị thiếu dinh dưỡng, nếu kéo dài sẽ dẫn tới suy dinh dưỡng. Chẩn đoán dị tật hở hàm ếch khá đơn giản dựa vào khám và nội soi tai mũi họng.
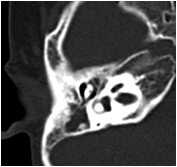
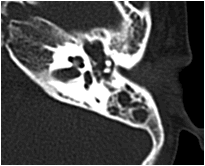
Về thính giác: khoảng 60% trẻ có biểu hiện nghe kém, nguyên nhân do dị tật hở hàm ếch dẫn tới viêm tắc vòi Eustachian, tụ dịch trong tai giữa, lâu dài dẫn tới viêm tai giữa mạn tính. Chẩn đoán tổn thương tai giữa dựa trên thăm khám lâm sàng, đo thính lực và phim chụp cắt lớp vi tính độ phân giải cao, tái tạo hình ảnh theo mặt phẳng ngang và đứng ngang. Trong tai giữa và xoang chũm thường chứa nhiều dịch dẫn tới giảm thính lực. Đây là môi trường lý tưởng cho nhiễm trùng, quá trình viêm thường diễn ra lặp đi lặp lại nhiều lần (hình 5).
Hình 5: Hình ảnh tụ dịch trong tai giữa hai bên
Vấn đề về phát âm: do bệnh nhân có hở hàm ếch nên phát âm mũi, nếu hở lớn có thể dẫn tới phát âm không rõ. Cùng với vấn đề về thính giác nên bệnh nhân thường chậm nói, ảnh hưởng đến sự phát triển ngôn ngữ và khả năng giao tiếp kém.
Bệnh nhân của chúng tôi có biểu hiện tụ dịch trong tai giữa và xoang chũm hai bên, chức năng nghe kém và hiện tại chưa biết nói.
Về phát triển trí tuệ: Bệnh nhân SPR có thể phát triển trí tuệ bình thường nếu không bị thiếu oxy và dinh dưỡng ở giai đoạn sau sinh.
Bất thường về răng: Bệnh nhân SPR thường có các bất thường về vị trí răng và khớp cắn bị lệch. Tuy nhiên không nên can thiệp quá sớm, bệnh nhân cần được khám chuyên khoa răng hàm mặt và chỉnh nha khi trẻ đủ lớn (hình 6).

Hình 6: Hình ảnh bất thường khớp cắn lệch và vị trí răng.
Về chẩn đoán các hội chứng phối hợp [8]:
Thông thường SPR đơn thuần thường gặp nhất chiếm khoảng 50% các trường hợp tuy nhiên để chẩn đoán xác định SPR đơn thuần nên đợi khoảng 12 tháng sau khi trẻ ra đời do có thể xuất hiện các bất thường khác muộn hơn.
Hội chứng Stickler (khoảng 18% các trường hợp) . Ngoài các dấu hiệu về hàm mặt của chuỗi các triệu chứng Pierre Robin, trong hội chứng Stickler, bệnh nhân còn mắc một số các bất thường khác:
– Mũi tẹt: mũi nhỏ, xương sống mũi dẹt hơn so với bình thường
– Bất thường về mắt: cận thị, đục thủy tinh thể, tăng nhãn áp, bong võng mạc
– Bất thường về xương khớp: biên độ khớp rộng, viêm xương khớp, ngón tay dài, vẹo cột sống.
Các triệu chứng trên nặng hoặc nhẹ tùy từng bệnh nhân và độ tuổi khác nhau.
Hội chứng DiGeorge (7-15% các trường hợp) do đột biến nhiễm sắc thể 22 [3]. Các dị tật thường gặp là dị tật tim, bất thường hàm mặt, bất sản tuyến giáp, hở hàm ếch, hội chứng giảm canxi máu và hội chứng suy cận giáp.
Bệnh nhân của chúng tôi thuộc nhóm Pierre Robin đơn thuần, không có các dị tật khác phối hợp.
Về mức độ nặng của bệnh, theo một số tác giả [4] :
Độ 1: Khoảng ¼ số trẻ mắc bệnh ở mức độ 1: không có biểu hiện khó thở nhưng có biểu hiện thở rít.Trào ngược dạ dày thực quản nhẹ.
Độ 2: 2/3 mắc bệnh ở mức độ 2. Khó thở nhẹ và thường có viêm nhiễm đường hô hấp. Bệnh nhân nhai và nuốt khó khăn, trào ngược dạ dày thực quản thường xuyên
Độ 3: Thường xuyên khó thở, xuất hiện từ khi mới sinh, biểu hiện tím tái. Bệnh nhân thường không nhai và nuốt được, trào ngược dạ dày thực quản mức độ nặng và thường xuyên
Như vậy phân chia mức độ nặng của hội chứng Pierre Robin chủ yếu dựa vào tình trạng hô hấp và dinh dưỡng của bệnh nhân nhằm mục đích tiên lượng. Việc điều trị cũng chủ yếu ưu tiên cải thiện các triệu chứng này.
3.3. Về điều trị
Cải thiện chức năng hô hấp, theo tác giả Van den Elzen[4], có tới 52/74 các trường hợp cần các phương pháp hỗ trợ hô hấp. Đơn giản nhất là tư thế ngủ nằm sấp hoặc nằm nghiêng giúp cho đường thở thông thoáng hơn, đa số các bệnh nhân có đáp ứng tốt với việc thay đổi tư thế ngủ. Một số trường hợp phải khâu treo lưỡi ra trước. Mở khí quản được chỉ định khi bệnh nhân khó thở nặng, không đáp ứng với các phương pháp trên, tuy nhiên việc chăm sóc đường mở khí quản khó thực hiện tại nhà và nguy cơ nhiễm khuẩn đường hô hấp rất cao.
Cải thiện dinh dưỡng: Ở các trẻ sơ sinh với biểu hiện bú kém, không đủ cân so với tuổi, việc đặt sonde dạ dày và bơm sữa là biện pháp tạm thời, nếu cần phải mở thông dạ dày cho ăn tới khi bệnh nhân được 1-2 tuổi. Phương pháp tạo hình xương hàm dưới sau đó có thể được tiến hành vừa nhằm mục đích thẩm mỹ, vừa cải thiện chức năng nhai và nuốt thức ăn.
Điều trị các bất thường vùng hàm mặt [6,7] :
Phẫu thuật hở vòm họng khi trẻ đủ cân nặng giúp giảm ho sặc khi ăn và giảm viêm tai giữa, phục hồi khả năng phát âm và nghe.
Phẫu thuật tạo hình xương hàm dưới bằng dụng cụ đặc biệt [7] giúp tạo hình thẩm mỹ, đồng thời cải thiện các triệu chứng trên. Phương pháp này thường được thực hiện ở giai đoạn 1 hoặc 2 tuổi. Sau khi chụp cắt lớp vi tính, tái tạo xương hàm dưới, ta có thể thiết kế được dụng cụ phù hợp nhất với từng bệnh nhân giúp việc tạo hình đạt hiệu quả tối ưu. Phương pháp này đã được thực hiện khá phổ biến ở các nước phát triển tuy nhiên chi phí lớn nên hiện nay chưa triển khai được ở Việt Nam[hình 7].

Hình 7: Dụng cụ tạo hình xương hàm dưới.
IV. KẾT LUẬN
Hội chứng Pierre Robin là một chuỗi các dị dạng bẩm sinh hiếm gặp, do xương hàm dưới không phát triển.Vai trò của chẩn đoán hình ảnh là chẩn đoán chính xác, đầy đủ các dị tật nhằm mục đích lập phương án điều trị tốt nhất cho bệnh nhân. Phương pháp chụp cắt lớp vi tính mỏng và tái tạo hình ảnh theo các mặt phẳng khác nhau là phương pháp có thể chẩn đoán được hầu hết các dị tật vùng hàm mặt – sọ não.
Điều trị bệnh nhân Pierre Robin nhằm mục đích đảm bảo đường thở thông thoáng và dinh dưỡng tốt. Giai đoạn dưới 1 tuổi cần điều trị tạm thời, sau 1 tuổi khi trẻ đủ cân nặng có thể phẫu thuật chỉnh sửa hàm mặt nhằm cải thiện chức năng và thẩm mỹ cho bệnh nhân. Trẻ có thể phát triển trí não và thể chất bình thường.
V. TÀI LIỆU THAM KHẢO
1. Pierre Robin (1923). “ La glossoptose. Son diagnostic, ses consequences, son traitement”. Journal de médecine de Paris, 43: 235-237.
2. Pierre Robin syndrome. Dorland’s Medical Dictionary
3. Jakobsen LP, Knudsen MA, Lespinasse J, et al (2006). “The genetic basis of the Pierre Robin Sequence”. Cleft Palate Craniofac. J. 43 (2): 155–159.
4. Van den Elzen AP et al (2001). “Diagnosis and treatment of the Pierre Robin sequence: results of a retrospective clinical study and review of the literature”. Eur. J. Pediatr. 160 (1): 47–53.
5. Michael Entezami et al, “Ultrasound Diagnosis of Fetal Anormalies” Thieme . 44 (2): 35-39
6. Jose O, Atonio M (2001) , “Surgical management of Pierre Robin sequence by Beverli Douglas technique. Case report” Biosci J. V.17, n.1, p.17-23.
7. Sesenna et al, 2012. “Mandibular distraction in neonates :indications, technique, results”. ItalianJournalofPediatrics , 38:7
8. Adele .K.E et al(2006) , ‘Robinsequence:A retrospective review of 115 patients’ International Journal of Pediatric Otorhinolaryngology 70,973—980
9. Rotten D et al (2002) , ‘ The fetal mandible: a 2D and 3D sonographic approach to
the diagnosis of retrognathia and micrognathia’. Ultrasound Obstet Gynecol 2002; 19: 122–130.